Sir Lawrence Bragg era uno de esos científicos cuyo juvenil entusiasmo por la investigación nunca declinó. Era también muy aficionado a la jardinería. Cuando dejó la gran casa con jardín de West Road, en Cambridge, para vivir en Londres, con objeto de dirigir la Royal Institution en Albemarle Street, ocupó el apartamento oficial en lo alto del edificio. Como echaba de menos su jardín, se las arregló para que una tarde a la semana le contratasen como jardinero de una dama desconocida que vivía en The Boltons, un elegante suburbio de Londres. La saludaba respetuosamente con el sombrero y decía llamarse Willie. Durante muchos meses todo fue bien, hasta que un día una visita, tras echar un vistazo por la ventana, dijo a su anfitriona: «Querida, ¿qué hace Sir Lawrence Bragg en tu jardín?». Recuerdo más de un caso de científicos de su categoría haciendo cosas de este estilo.
Bragg tenía el don de ver los problemas en términos sencillos, y se había dado cuenta de que la mayoría de complicaciones aparentes pueden desaparecer si se pone al descubierto el patrón interno básico. Por lo tanto no es extraño que en 1950 quisiera demostrar que al menos partes de la cadena polipeptídica se plegaban de una manera simple. Esta aproximación no era del todo nueva. Bill Astbury, cristalógrafo, había intentado interpretar sus diagramas de rayos X de la queratina (la proteína del pelo y de las uñas) utilizando modelos moleculares con repeticiones regulares. Había encontrado dos formas en estos diagramas de fibras, que denominó α y β. Su idea de la estructura β no se hallaba lejos de la verdad, pero su sugerencia respecto a la estructura α estaba muy alejada. Por una parte, ello se debió a que era un constructor de modelos poco cuidadoso y no lo suficientemente meticuloso con las distancias y ángulos, y por otra a que las pruebas experimentales eran de tal modo confusas que hubiera sido muy difícil ver con claridad.
Era bien conocido el hecho de que cualquier cadena con idénticos enlaces repetidos que se pliegue de manera que cada enlace quede plegado exactamente del mismo modo, y manteniendo la misma relación con sus vecinos, formará una hélice (a veces erróneamente llamada espiral por los no matemáticos). Las soluciones extremas —una línea recta o un círculo— se consideran matemáticamente como hélices degeneradas.
La formación de Bragg era la de un físico, y la mayor parte de su trabajo sobre estructura molecular había sido realizada con materiales inorgánicos, como los salicilatos. No conocía al detalle la química orgánica ni la química-física implicada, aunque naturalmente comprendía las bases de ambas disciplinas. Llegó a la conclusión de que una buena aproximación sería construir modelos regulares del esqueleto polipeptídico, ignorando las complejidades de las cadenas laterales. Una cadena polipeptídica tiene como esqueleto una secuencia regular de átomos, con la repetición …CH–CO–NH… (donde C es el carbono, H el hidrógeno, O el oxígeno y N el nitrógeno). La manera en que los átomos están unidos entre sí se muestra en el apéndice A. Cada CH posee un pequeño grupo de átomos unidos —con frecuencia denominado R por los químicos, siendo R un Residuo—. Aquí llamaremos R a la cadena lateral. Ahora sabemos que sólo hay veinte cadenas laterales distintas que se encuentran normalmente en las proteínas. Para el residuo más pequeño, la glicina, R es tan sólo un átomo de hidrógeno, apenas es una cadena. El siguiente en tamaño se denomina alanina y posee un grupo metilo (CH3) como cadena lateral. Los otros son de tamaño variable. Algunos presentan una carga eléctrica positiva, otros negativa, y otros no tienen carga. La mayoría son bastante pequeños. Los mayores, triptófano y arginina, sólo tienen dieciocho átomos en su cadena lateral. Los nombres de los veinte (pero no sus fórmulas) están enumerados en el apéndice B.
Esta cadena polipeptídica se construye uniendo pequeñas moléculas llamadas aminoácidos. (Los detalles químicos se dan en el apéndice A.) Cuando una proteína es sintetizada, los aminoácidos relevantes se unen, cabeza con cola, con eliminación del agua, formando un largo cordel que se llama cadena polipeptídica. Tal como he explicado, el orden exacto de los aminoácidos de una proteína determinada, que está dictaminado por su gen, define su carácter. Lo que debemos saber es cómo una cadena polipeptídica concreta se pliega en la estructura tridimensional de la proteína y cómo se disponen exactamente todas las cadenas laterales (algunas de ellas son ligeramente flexibles) en el espacio, para así poder comprender cómo una proteína ejerce su función. Bragg, junto con otros, quería descubrir con la construcción de modelos si la cadena polipeptídica principal se plegaría regularmente una o más veces. Había indicios, a partir de los patrones α y β de rayos X de Astbury, de que ello era posible.
Así pues, sólo trabajaron con el esqueleto polipeptídico e ignoraron las cadenas laterales. Quizá no esté claro por qué se tenía que construir un modelo, ya que la estructura química simple de una unidad del esqueleto ya estaba bien establecida. Se conocían todas las distancias y todos los ángulos de los enlaces. Sin embargo, puede haber fácilmente una rotación en los enlaces llamados simples (pero no en los enlaces dobles) y la configuración exacta de los átomos en el espacio depende justamente de cómo se fijan estos ángulos de rotación. Esto suele depender de las interacciones entre átomos que se encuentran un poco alejados entre sí en la cadena y pueden darse alternativas posibles distintas especialmente si dichas interacciones son débiles.
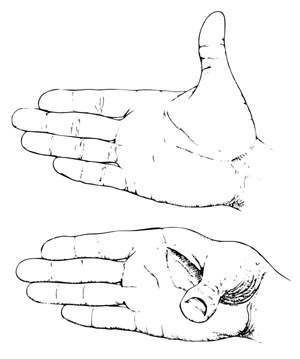
Puede que la razón de esta flexibilidad no se vea claramente de inmediato. Un modo fácil de verlo es observando una mano. Colóquese una de las manos de manera que todos los dedos estén en un mismo plano, con el pulgar en ángulo recto respecto al índice. El pulgar se puede mover y conservar al mismo tiempo este ángulo recto, aunque la forma tridimensional de la mano esté cambiando (véase figura 5.1). Esto es cierto incluso si todas las distancias (con el vecino más próximo) son constantes —la longitud del pulgar y de cada dedo—, así como los ángulos entre ellos. Sólo cambia el llamado ángulo dihedral (entre el plano de los cuatro dedos y el plano que contiene el pulgar y el índice). Un ejemplo de interacción a cierta distancia, a la que nos hemos referido antes, sería la distancia variable entre la uña del pulgar y la uña del meñique.

Figura 5.1 El pulgar puede moverse dando diferente forma a la mano, mientras se conservan todos los ángulos directos y las distancias.
En el caso de una molécula química, tienen que existir interacciones de algún tipo si la molécula va a adoptar una configuración determinada. Estaba claro que la mejor manera de que una cadena polipeptídica se plegara sobre sí misma era que formara puentes de hidrógeno entre determinados átomos de su esqueleto. Los puentes de hidrógeno son enlaces débiles. Su energía es sólo un múltiplo pequeño de la energía térmica (a temperatura ambiente), y por ello un puente de hidrógeno se rompe fácilmente por la constante de agitación térmica. En parte, a ello se debe que el agua sea un fluido a temperatura y presión normales. El puente de hidrógeno se forma a partir de un átomo dador (con el puente de hidrógeno unido a él) y un receptor. En una cadena polipeptídica el único dador fuerte es el grupo NH, y el único receptor probable el O del grupo CO. John Kendrew señaló que este puente de hidrógeno produce un determinado anillo de átomos. Enumerando todos los anillos posibles de este tipo, se determinan todas las estructuras posibles, cada una de ellas caracterizada por el grupo NH unido a un grupo CO concreto, por ejemplo uno que esté tres repeticiones alejado en la cadena. Este enlace se va repitiendo a lo largo de toda la cadena. Así, los múltiples puentes de hidrógeno formados ayudan a estabilizar la estructura frente al embate del movimiento térmico.
Utilizando un modelo especial de átomos hechos de metal, y con enlaces fabricados a escala con gran exactitud, Bragg, Kendrew y Perutz construyeron sistemáticamente todos los modelos posibles, excepto aquellos cuyos plegamientos no eran suficientemente compactos. Esperaban que uno de los modelos encajara mucho mejor que los restantes con los datos de rayos X. Por desgracia, no dejaron que los modelos adquirieran las configuraciones más favorables. Astbury había demostrado que el patrón α presentaba una fuerte mancha por rayos X en el denominado meridiano, con una separación de 5,1 Å correspondiente a una repetición en la dirección de la fibra. Esto implicaba que un aspecto importante de la estructura se repetía a esta distancia, probablemente el «paso de rosca», o sea la distancia entre dos giros consecutivos. Como esta mancha se hallaba exactamente en el meridiano, sugería que el eje de rotación (el elemento de simetría asociado a una hélice regular) era un entero, aunque no indicaba cuál. Bragg señaló que podía ser una simetría doble, triple, cuádruple o, incluso, quíntuple o más. Como se ha dicho anteriormente, el dibujo de un papel de pared —un patrón bidimensional repetido— no puede tener una simetría quíntuple, pero no había ninguna razón por la que una hélice polipeptídica única no pudiera tener un eje de rotación quíntuple. Esto significa simplemente que si se hace girar la hélice 72 grados (360 grados dividido por cinco) y al mismo tiempo se traslada la estructura sobre su eje a una cierta distancia, parecerá exactamente igual, si no se tienen en cuenta los efectos de los extremos.
Por esta razón Bragg, Kendrew y Perutz construyeron todos sus modelos con ejes de paso enteros. También los construyeron de un modo poco cuidadoso. Un determinado grupo de átomos, el llamado enlace peptídico, en realidad tendría que haber sido planar —los seis átomos implicados deberían estar en un mismo plano o muy cerca de él—, pero ellos permitieron una rotación del enlace peptídico, lo que hizo que sus modelos fueran demasiado adaptables.
En resumen, hicieron que una característica fuera demasiado restrictiva (la naturaleza exacta del eje de rotación) y se mostraron muy permisivos con otra, la planaridad del enlace peptídico. No es extraño que todos los modelos parecieran horrorosos, y que sus creadores fueran incapaces de decidir cuál era el mejor. De mala gana publicaron sus resultados en Proceedings of the Royal Society, aunque sabían que de ningún modo eran concluyentes. Fue entonces cuando me pidieron que leyera las pruebas de este artículo (creo que las pruebas debieron de llegar cuando los autores ya estaban fuera del laboratorio), pero yo ignoraba los puntos más sutiles de la investigación para detectar qué era lo que estaba mal.
Sin el conocimiento de mis colegas, Linus Pauling estaba siguiendo los mismos pasos. Actualmente es conocido por el gran público como el paladín de la vitamina C. En aquel tiempo probablemente era el químico más importante del mundo. Había sido pionero en la aplicación de la mecánica cuántica a la química (proceso en el que explicó, por ejemplo, por qué el carbono tiene una valencia de cuatro) y era profesor de química en el California Institute of Technology, donde dirigía varios grupos de investigadores con talento. Estaba especialmente interesado en la utilización de la química orgánica para explicar fenómenos biológicos importantes.
Pauling ha descrito cómo dio por primera vez con la hélice α mientras se hallaba confinado en cama con un resfriado, durante su estancia en Oxford como profesor visitante en 1948. Su artículo más importante sobre la hélice α apareció, junto con otros de sus trabajos, en Proceedings of the National Academy of Sciences en la primavera de 1951. Pauling sabía que el enlace peptídico era casi plano, más que nada porque conocía mejor la química-física orgánica que los tres investigadores de Cambridge. No intentó hacer una estructura con un número entero de pasos sino que dejó que los modelos se plegaran de un modo natural y que se acomodaran al número de pasos más cómodo. Resultó que la hélice α sólo tenía 3,6 unidades por giro. Tuvo noticia de la existencia de un artículo de Bamford, Hanby y Happey, los investigadores de polímeros, que trataba de la difracción de rayos X de un polímero sintético y que se adaptaba bastante bien a su modelo. Dejó a un lado el hecho de que su modelo no explicara la reflexión de 1,5 Å sobre el meridiano. Lo paradójico fue que Bragg, Kendrew y Perutz habían construido un modelo, entre otros, que de hecho era una hélice α, pero la habían deformado para que tuviera un eje cuádruple. Esto le daba un aspecto forzado, como en realidad era.
Pronto quedó claro que la hélice α de Pauling era la solución correcta. Bragg se quedó bastante abatido. Subió las escaleras lentamente. [Cuando a Rutherford le iban bien las cosas subía las escaleras saltando y cantando Onward Christian Soldiers (Adelante, soldados cristianos).] Bragg calificó su fracaso como «la mayor equivocación de mi carrera científica». El hecho de que hubiera sido nada menos que Linus Pauling quien hallara la solución al problema no era de gran ayuda, puesto que Bragg había sido abatido justo antes de la meta. Perutz sabía que después de uno de sus seminarios, un físico químico local le había dicho que el enlace peptídico debía de ser plano. Perutz incluso lo había apuntado en sus notas, pero no hizo nada más. No se trataba de que no hubieran procurado asesorarse bien, pero algunos de los consejos recibidos habían sido muy desafortunados. Charles Coulson, químico teórico de Oxford, les había dicho, en mi presencia, que el átomo de nitrógeno podía ser «piramidal», información totalmente equivocada.
El honor se salvó en parte cuando Perutz observó que la hélice α debería presentar una fuerte reflexión en el meridiano a 1,5 Å, correspondiente a la altura de estadios sucesivos de la hélice, y efectivamente lo comprobó. Junto con otros dos cristalógrafos, Vladimir Vand de la universidad de Glasgow y Bill Cochran del Cavendish, determiné la naturaleza general de la Transformada de Fourier de un conjunto de átomos dispuestos en una hélice regular, y Cochran y yo demostramos que se adaptaba bastante bien al patrón de rayos X de un polipéptido sintético. Pero en cierto modo nos estábamos echando sal sobre nuestras propias heridas.
¿Cuál era entonces la explicación de la mancha errónea a 5,1 Å? Poco después Pauling y yo llegamos a la respuesta correcta. Las hélices α no pueden empaquetarse con facilidad una junto a otra debido a que su paso de rosca no es un entero. Se empaquetan mejor cuando existe un ángulo pequeño entre ellas, y si se deforman ligeramente, esto conduce a una espiral en espiral, es decir dos o tres hélices α empaquetadas una junto a otra pero enrollándose ligeramente en espiral una sobre otra (un bello ejemplo de ruptura de simetría por una interacción débil). Esta espiral adicional desplazaba la mancha del meridiano a 5,4 Å hasta el meridiano a 5,1 Å.
Se podría argumentar que puesto que las hélices α se encuentran exclusivamente en las moléculas biológicas, un modelo de esqueleto polipeptídico no debería rechazarse sólo por ser horroroso. Preferiría decir que a causa de su simplicidad molecular, la hélice α básica está más próxima de la química-física que de la biología. A este nivel hay pocas posibilidades de que la evolución funcione. Sólo cuando se tienen en cuenta las cadenas laterales, y las numerosas maneras en que una cadena polipeptídica puede doblarse sobre sí misma, se hace posible una gran variedad de estructuras. Así pues, la simplicidad puede conducir fácilmente a la sofisticación. La elegancia, si existe, puede ser mucho más sutil y lo que a primera vista parece artificial o incluso horrible quizá sea la mejor alternativa que la selección haya podido diseñar.
Jim Watson y yo quedamos muy impresionados por este fallido intento de mis colegas en descubrir la hélice α. A causa de ello comprendí que era importante no dar relevancia a una de las pruebas experimentales en perjuicio de las demás, lo que puede desembocar en un error como indudablemente lo fue la reflexión a 5,1 Å. Jim era un poco más impetuoso, y afirmaba que ningún modelo bueno confirmaba todos los hechos, ya que algunos datos podían estar equivocados, cuando no totalmente erróneos. Una teoría que concordase con todos los datos tenía que haber sido «manipulada» y por lo tanto debería estar bajo sospecha.
Se ha dicho que el modelo de Pauling de hélice α o su modelo incorrecto del DNA nos sugirió la idea de que el DNA era una hélice. Nada más lejano de la realidad. Las hélices estaban en el ambiente y había que ser muy obtuso o muy obstinado para no pensar en líneas helicoidales. Lo que Pauling nos enseñó es que la construcción meticulosa y exacta de un modelo podía representar una limitación que, en cualquier caso, la respuesta final debía satisfacer. En algunas ocasiones, esto podía conducir a la estructura correcta, empleando solamente un mínimo de pruebas experimentales directas. Esta fue la lección que recibimos y que Rosalind Franklin y Maurice Wilkins no supieron apreciar cuando intentaron descifrar la estructura del DNA. Y junto con esto, la necesidad de no hacer suposiciones sobre las cuales no surgieran dudas de vez en cuando. También hay que decir que Jim y yo estábamos muy motivados para triunfar, aunque nuestras aproximaciones a los problemas fueran muy relajadas; éramos rápidos en reconocer el éxito cuando lo veíamos y en sacar lecciones tanto de los éxitos como de los fracasos.
La hélice α fue un acontecimiento importante en el tortuoso camino de la biología molecular, pero no tuvo el mismo impacto que la doble hélice del DNA. En un principio esperamos que, dados los plegamientos básicos de las hélices α y los planos β, se pudiera resolver la estructura de una proteína construyendo el modelo directamente. Por desgracia, la mayoría de proteínas son demasiado complejas y sofisticadas para ello. En resumen, estos dos clichés estructurales nos pusieron sobre aviso en cuanto a lo que cabía esperar de algunas partes de una proteína, pero no revelaron inmediatamente el secreto de la especificidad y actividad catalítica de una proteína concreta. Por el contrario, la estructura del DNA puso de manifiesto inmediatamente su mecanismo, sugiriendo súbitamente cómo podrían replicarse exactamente los ácidos nucleicos. En el fondo, el DNA es una molécula mucho menos sofisticada que una proteína evolucionada y por esta razón revela sus secretos más fácilmente. No podíamos saberlo por adelantado: sólo fue cuestión de suerte tropezar con una estructura tan bella.
Pauling fue en biología molecular una figura más importante de lo que a veces se cree. No sólo hizo algunos descubrimientos clave (por ejemplo que la anemia falciforme era una enfermedad molecular), sino que tenía la aproximación teórica exacta a estos problemas biológicos. Creía que mucho de lo que quedaba por saber podía explicarse utilizando ideas químicas bien fundadas, en especial la química de macromoléculas, y que nuestros conocimientos sobre los diversos átomos, especialmente el carbono, y sobre los enlaces que mantienen los átomos juntos (el enlace homopolar, las interacciones electrostáticas, los puentes de hidrógeno y las fuerzas de Van der Waal), serían suficientes para desvelar los misterios de la vida.
Por el contrario Max Delbruck, que en sus inicios fue físico, esperaba que la biología permitiría descubrir nuevas leyes físicas. Delbruck también trabajó en Cal Tech, donde se encontraba Pauling. Había sido pionero en el estudio de ciertos virus llamados bacteriófagos («fago», de forma abreviada) y era uno de los líderes del muy influyente Grupo de los Fagos, del cual Jim Watson era el miembro más joven. No creo que a Delbruck le importara mucho la química. Como la mayoría de físicos, consideraba que la química era una aplicación trivial de la mecánica cuántica. No imaginó las estructuras extraordinarias que la selección natural puede llegar a producir, ni cuántos tipos distintos de proteínas pueden existir.
Hasta ahora el tiempo ha demostrado que Pauling tenía razón y que Delbruck estaba equivocado, tal como éste reconoció en su libro Mind into Matter. Todo lo que sabemos sobre la biología molecular parece ser explicable de un modo químico estándar. Ahora también reconocemos que la biología molecular no es un aspecto trivial de los sistemas biológicos. Es el núcleo de la cuestión. Casi todos los aspectos de la vida están gestionados en un nivel molecular, y sin conocer las moléculas sólo se puede tener un conocimiento parcial de la propia vida. Cualquier aproximación a un nivel superior se considerará sospechoso hasta que no se haya confirmado en el nivel molecular.