
En los dos capítulos precedentes me he ocupado de ciencias básicas como son la matemática, la física y, en menor medida, la astronomía. Pero con ser importantes, es evidente que estas disciplinas no agotan el conjunto de las ciencias. Y entre las que faltan, hay una particularmente importante: la química, la disciplina que Lavoisier, el principal protagonista del presente capítulo, definió de la siguiente forma en su Traité elementaire de chimie (Tratado elemental de química; 1789): «La química, experimentando con los diversos cuerpos de la naturaleza, tiene por objeto descomponerlos, de forma que se puedan examinar separadamente las diferentes sustancias que entran en su combinación». Es, ciertamente, una definición un tanto limitada —se olvida, por ejemplo, de que también es objeto de la química el estudio de las fuerzas que unen los elementos constitutivos de las sustancias—, pero sirve.
Si no he mencionado a la química hasta ahora, no es, naturalmente, porque en las épocas en las que me he centrado hasta el momento no se llevasen a cabo «actividades químicas», es decir, trabajos o investigaciones que tenían que ver con lo que hoy llamamos química, sino porque con anterioridad a mediados del siglo XVIII, esta ciencia no podía considerarse una disciplina científica independiente, o, dicho de otra manera, probablemente más conveniente, porque no existía un sistema estructurado, con un cierto poder predictivo, con el que fuese posible organizar de manera sistemática las relaciones entre cuerpos que al combinarse dan lugar a compuestos de todo tipo. Los historiadores de la química no tienen la fortuna de sus colegas los historiadores de la matemática o, aunque en un grado menor, los de la astronomía y la física: la fortuna de que una parte importante del pasado matemático se perdiese surgiendo reconstruido con la limpieza, rigor y claridad con que aparece en obras como los Elementos de Euclides. El historiador de la química anterior a, digamos, los siglos XVII y XVIII, se ve obligado a prestar atención a múltiples y muy variados temas e intereses, demasiados y excesivamente atomizados. Como, por ejemplo, las artes de la destilación, la obtención de esencias perfumadas, la fabricación de jabón, las aleaciones metálicas o los remedios farmacéuticos, a las que, en diferentes escenarios espacio-temporales, contribuyeron griegos, romanos, árabes y los europeos medievales y renacentistas.
Los anteriores ejemplos tienen que ver, evidentemente, con lo que podríamos denominar «prácticas tecnológicas» motivadas por necesidades sociales. Y aunque requerían de un cierto aparato teórico —nada es absolutamente «práctico», «experimental» o «empírico»—, éste no fue, al menos al principio, grande. Sin embargo, también encontramos en los siglos anteriores al XVII, y en concreto en la civilización helena, desarrollos, reflexiones, teorías, que pertenecen al universo de lo que hoy denominamos química. En particular, en lo que se refiere a la constitución de la materia.
Pocas cuestiones, en efecto, surgen al espíritu de manera más inmediata que la de cómo están formados los cuerpos que nos rodean y de los que formamos parte. Ya he mencionado que Tales la formuló, dando preferencia en su respuesta al agua. Más refinadas fueron las respuestas que dieron Heráclito de Éfeso (540-480 a.C.) y Anaxágoras (500-428 a.C.), que sostuvieron la creencia de que toda la materia está formada por cuatro elementos: fuego, agua, aire y tierra, una doctrina que, como ya mencioné a propósito de Galileo, tendría una larga vida. De hecho, aunque Galileo sembrara de minas los territorios aristotélico-ptolemaicos, la teoría de los cuatro elementos (cinco si añadimos el éter) se defendió con cierta dignidad. Y es que el estudio de los componentes de la materia y, en general, de todo aquello que existe en la naturaleza, constituye un problema de extraordinaria dificultad. Acaso porque no nos damos cuenta de semejante complicación, tendemos a mirar en la actualidad con un apenas disimulado desprecio a intentos de profundizar en la composición de los cuerpos como el protagonizado por los alquimistas.
Una química primitiva: la alquimia
La alquimia, cuyos orígenes se remontan cuando menos a la Alejandría de los Ptolomeos, es un arte difícil de definir. Una definición que a mí me gusta es la que dio en 1970 E. J. Sheppard, en la que se recoge su dimensión de empresa filosófico-religioso-existencial: «La alquimia —señalaba Sheppard— es un arte cósmico mediante el cual se pueden liberar partes [del] cosmos —las partes mineral y animal— de su existencia temporal obteniendo estados de perfección, oro en el caso de los minerales, y para los humanos, longevidad, inmortalidad, y finalmente redención. Semejantes transformaciones pueden lograrse bien mediante la utilización de una sustancia material como la “piedra filosofal” o elixir, o bien a través de conocimiento revelado o iluminación psicológica».
La obra y pensamiento de Philippus Theophrastus (1493-1541), el médico y alquimista suizo más conocido como Paracelso, constituye un ejemplo casi paradigmático de esta forma de entender la alquimia. Como médico que era —y parece que cosechó algunos éxitos importantes (en la losa que cubre su tumba en la iglesia de San Esteban de Salzburgo, se puede leer todavía el siguiente epitafio: «Aquí yace Theophrastus Bombastus von Hohenheim. Famoso doctor en medicina, que curó toda clase de heridas, la lepra, la gota, la hidropesía y otras varias enfermedades del cuerpo, con ciencia maravillosa»)—; como médico, digo, que era estaba interesado en combatir las enfermedades. Cómo lo hacía, cuál era su concepción de la medicina, es algo complicado de establecer y explicar; aun así, diré que en tal concepción desempeñaba un papel importante el arte alquímico. En el capítulo tercero —«Sobre el método de acción de las tres primeras sustancias, el sujeto intermedio y la Alquimia»— de su Liber Paramirum, 1562 (Libro Paramírico), leemos: «Las enfermedades extrañas requerirán que el médico las estudie con métodos extraños, aplicándoles las concordancias que correspondan, preparando y separando las cosas visibles y reduciendo sus cuerpos a la última materia con ayuda del arte espagírico o de la Alquimia». Y unas pocas líneas más abajo añadía: «Aprended pues la Alquimia, también llamada Espagírica y ella os enseñará a discernir lo falso de lo verdadero. Con ella poseeréis la luz de la Naturaleza y con ella podréis probar todas las cosas claramente, discurriéndolas de acuerdo a la lógica y no por la fantasía, de la que nada bueno puede resultar».

Jan Van der Straet, llamado Lo Stradano («El alquimista»), 1570 (Florencia, Palazzo Vecchio).
Vemos que Paracelso hacía alquimia sinónimo de «espagírica», un término muy elocuente: spagyria proviene, en efecto, de las raíces griegas «sacar, extraer, separar» y «reunir», dos raíces etimológicas en las que se encuentran los dos conceptos u operaciones fundamentales de la química: el análisis y la síntesis. Una acepción de espagírica es «arte de depurar metales».
Una gran parte de los alquimistas eran, como Paracelso, médicos, también farmacéuticos. En esta tradición se inscriben algunas de las figuras más destacadas de la historia de la química de mediados del siglo XVII y del XVIII: como Hermann Boerhaave (1668-1738), Georg Ernst Stahl (1660-1734) o Joseph Black (1728-1799). Pero antes de entrar en esa época, y en particular en el período de la Ilustración, quiero mencionar el caso de Isaac Newton, que dedicó intensos esfuerzos a la investigación alquímica, hasta el punto de que es considerado como uno de los alquimistas más notables de la historia.

Paracelso.
Newton se vio atraído por los estudios alquímicos a finales de la década de 1660 y comienzos de la de 1670. Insatisfecho con las respuestas que sus estudios teológicos y de filosofía natural le proporcionaban, encontró en la alquimia una posible fuente de esperanzas, forjando una pasión por el tema que le duraría al menos treinta años. Llegó a pensar que la piedra filosofal, el principio activo de la alquimia, estaba unida estrechamente con Cristo: ambos eran, al fin y al cabo, agentes de perfección y redención. Ahora bien, lo que ahora deseo señalar, para reforzar la conexión existente entre alquimia y química en un sentido moderno, es que semejantes ideas e intereses no fueron obstáculo para que también se plantease problemas fundamentales, que hoy consideramos pertenecientes a la teoría de la afinidad química (la rama de la química que se ocupa de las fuerzas que unen los elementos para formar compuestos). En la Óptica encontramos evidencias de ello. Así, en la Cuestión 31 de la edición de 1718 (añadida en la edición de 1706 con el número 23), podemos leer: «¿No poseen las pequeñas partículas de los cuerpos ciertos poderes, virtudes o fuerzas con los que actúan a distancia no sólo sobre la luz, reflejándola e inflexionándola, sino también unos sobre otros, para producir una gran parte de los fenómenos de la naturaleza? En efecto, es bien sabido que los cuerpos actúan unos sobre otros por las acciones de la gravedad, magnetismo y electricidad. Estos ejemplos muestran el talante y curso de la naturaleza, haciendo que no sea improbable la existencia de otras potencias atractivas además de éstas». Y más adelante: «Cuando el Aqua fortis o el espíritu de vitriolo se vierten sobre limaduras de hierro y las disuelven con gran calor y ebullición, ¿acaso este calor y ebullición no están causados por un violento movimiento de las partes, y acaso no muestra ese movimiento que las partes ácidas del líquido se precipitan con violencia sobre las partes del metal, insinuándose enérgicamente en sus poros hasta que se sitúan entre sus partículas externas y la masa más importante del metal, y rodeando dichas partículas las liberan de la masa principal y las dejan flotar en el agua?».

Portada de The Sceptical Chymist: or chymico-physical Doubts & Paradoxes (Londres, 1661) de Robert Boyle.
No fue, por supuesto, Newton el único, ni siquiera el principal, de los virtuosi de la Revolución Científica interesado en las prácticas químicas. Ninguna exposición de la química del siglo XVII estaría completa sin mencionar a Robert Boyle, y en particular a su libro The Sceptical Chymist (El químico escéptico; 1661), todo un clásico de la literatura científica. Escrito en forma de diálogo, en él Boyle defendía la hipótesis (teoría corpuscular) de que la materia está formada por átomos y conjuntos de átomos en movimiento, y que cualquier fenómeno es el resultado de colisiones de partículas (átomos, en última instancia). En ese mismo libro se encuentra una definición de elemento químico que se ha mantenido básicamente inmutable hasta la actualidad:
Y, para evitar equivocaciones, debo advertirle que ahora quiero decir por Elemento… ciertos cuerpos Primitivos y Simples, o perfectamente no mezclados; que no formados por ningún otro cuerpo, son los ingredientes de los que están compuestos todos aquellos denominados Cuerpos perfectamente mixtos, y en los que se disuelven en última instancia.
De hecho, Boyle sospechaba que ninguno de los elementos entonces aceptados —tierra, aire, fuego y agua en el esquema aristotélico; sal, sulfuro y mercurio en el de los paracelsianos— era realmente elemental, aunque no avanzase mucho en identificar qué sustancias eran realmente «elementales». En este sentido, su aportación fue más importante por lo que estimuló la teoría corpuscular de la materia (que recibiría poco después un nuevo empuje de Newton), que por lo que añadió a las técnicas puramente químicas. Y es que Boyle no fue en modo alguno un químico puro: llegó a la química desde la medicina, siendo esta disciplina la que le condujo, a través de la preparación de medicamentos, a la química, convirtiéndose rápidamente en un hábil experimentador al igual que pensador original en las artes químicas.
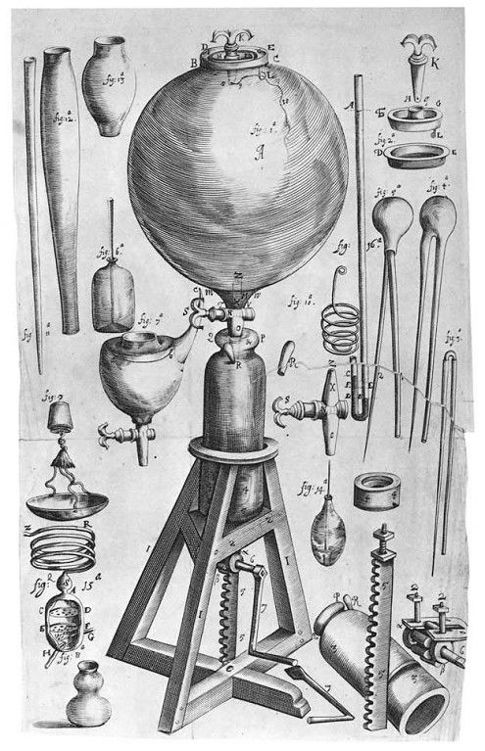
Lámina que representa diferentes instrumentos científicos: New Experiments Physico
mechanical (Oxford, 1662), de Robert Boyle.
Una de sus virtudes como investigador fue la manera en que combinó física y química, como muestran los experimentos que realizó utilizando una bomba de vacío, que le llevaron a concluir que el aire tenía peso. Semejante conclusión apareció en 1660 en New Experiments Physico-mechanical, touching the Spring of the Air, and its Effects (Nuevos experimentos mecánico-físicos, referentes al peso del aire y sus efectos), una idea que fue inmediatamente atacada por Franciscus Linus (1595-1675), y de la que Boyle se defendió en la segunda edición (1662) de su libro, en la que también incluyó la ley, desde entonces conocida por su nombre, de que el volumen ocupado por un gas es el recíproco de su presión.
Pero ya es hora de abandonar este sumario panorama de la historia de la química anterior al siglo XVIII y entrar en esta centuria, en la Ilustración (término introducido por Kant), en el Siglo de las Luces (el nombre preferido por los franceses); en definitiva, en el siglo que terminaría alumbrando una nueva revolución científica, que haría de la química una ciencia comparable a las demás. En el, en este sentido, «Siglo de Lavoisier», personaje, por otra parte, que representa de manera magnífica, en toda su grandeza y también en toda su tragedia, la centuria que terminó con otra revolución, ésta política: la Revolución Francesa.

Stephen Hales, según un grabado de Vegetable Staticks, or an account of some statical experiments on the sap in vegetables (Londres, 2 vols., 1727 y 1733).
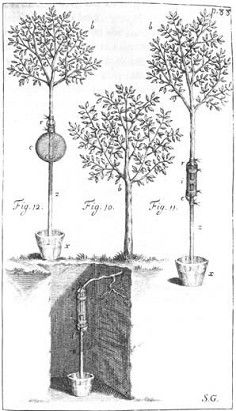
Lámina de Vegetable Staticks de Stephen Hales, en la que se muestra un experimento con un manzano y un peral para determinar el poder de absorción que eleva la savia en los árboles.
La Ilustración
Durante el Siglo de las Luces se consumó la transposición de la «propiedad» del concepto y estudio de la Verdad de la religión a la ciencia, de los teólogos y sacerdotes a los científicos y filósofos. En este sentido, se puede decir que terminaba la Era de la Cristiandad y comenzaba la de la Modernidad. Animados por la gran confianza que depositaron en la capacidad —científica y tecnológica— humana de comprender y utilizar la naturaleza, los ilustrados creyeron que era posible construir una sociedad más racional, justa y cómoda. Visto en retrospectiva, en su mayor parte el XVIII fue un siglo optimista, ilusionado, que veía en la ciencia y en la razón sus principales valedores. Esta unión entre «razón» y «naturaleza», entre ciencia, tecnología y sociedad, queda clara a través del título de la obra más característica de aquella época: la Enciclopedia o diccionario razonado de las ciencias, las artes y los oficios, la Encyclopédie (1751-1768), coordinada por el filósofo Denis Diderot (1713-1784) y el físico y matemático Jean Le Rond d’Alembert (1717-1783), autor él mismo de obras tan fundamentales para la ciencia del movimiento (fue básica para el posterior desarrollo de la mecánica analítica) como Trai té de dynamique, dans lequel les lois de l’équilibre et du mouvement des corps sont rédui tes au plus petit nombre possible (Tratado de dinámica, en el cual las leyes del equilibrio y del movimiento de los cuerpos son reducidas al número más pequeño posible; 1743). Con sus 35 tomos de voces (contiene 71.818 entradas) y láminas, la Encyclopédie constituye uno de los grandes monumentos editoriales dedicados al pensamiento.
El propio D’Alembert nos puede servir para familiarizarnos con los sentimientos de los ilustrados. En una de sus obras, Essai sur les éléments de philosophie (Ensayo sobre los elementos de filosofía), publicada en 1759 y ampliada en 1767, podemos leer:
La ciencia de la naturaleza adquiere día a día nuevas riquezas; la geometría ensancha sus fronteras y ha llevado su antorcha a los dominios de la física, que le son más cercanos; se conoce, por fin, el verdadero sistema del mundo, que ha sido desarrollado y perfeccionado. La ciencia natural ha cambiado su aspecto desde la Tierra hasta Saturno, desde la historia de los cielos hasta la de los insectos. Y, con ella, todas las demás ciencias han cobrado nueva forma… Todas estas causas han colaborado en la producción de una viva efervescencia de los espíritus. Esta efervescencia, que se extiende por todas partes, ataca con violencia a todo lo que se le pone por delante, como una corriente que rompe sus diques. Todo ha sido discutido, analizado, removido, desde los principios de las ciencias hasta los fundamentos de la religión revelada, desde los problemas de la metafísica hasta los del gusto, desde la música hasta la moral, desde las cuestiones teológicas hasta las de la economía y el comercio, desde la política hasta el derecho de gentes y el civil.

Henry Cavendish, según William Alexander (British Museum).
Estrictamente, no es verdad que todo fuese «discutido, analizado, removido». En el plano del desarrollo científico, y dejando al margen por el momento a la química, el siglo XVIII asistió a la encumbración de la física newtoniana. Era tal su poder explicativo, tantos sus éxitos, tanto lo que prometía, que, inevitablemente y tras una cierta resistencia de los seguidores del modelo vorticial de Descartes, se terminó por creer que en sus principios fundamentales, en las tres leyes de movimiento, se encontraba la llave para comprender el funcionamiento del universo. Otra cosa era ser capaces de calcular en detalle los diferentes movimientos, pero en principio ahí, en los movimientos de las partículas que se suponía componían la materia (mecanicismo), estaba todo. Así, en su Essai philosophique sur les probabilités (Ensayo filosófico sobre las probabilidades, 1814), Pierre-Simon Laplace (1749-1827), autor de obras tan importantes para esa física como el Traité de mécanique céleste (Tratado de mecánica celeste; 1799-1827), podía escribir: «Una inteligencia que en un momento determinado conociera todas las fuerzas que animan a la naturaleza, así como la situación respectiva de los seres que la componen, si además fuera lo suficientemente amplia como para someter a análisis tales datos, podría abarcar en una sola fórmula los movimientos de los cuerpos más grandes del universo y los del átomo más ligero; nada le resultaría incierto y tanto el futuro como el pasado estarían presentes ante sus ojos».

Joseph Black.

Joseph Priestley.
Pero no debemos pensar que el siglo XVIII se basó, en lo que a avance científico se refiere, únicamente en las ideas físicas del mecanicismo. El «espíritu matemático» se desarrolló también con gran intensidad; no en vano en el Setecientos vivieron matemáticos como Daniel Bernoulli (1700-1782), Leonhard Euler (1707-1783) o Joseph-Louis Lagrange (1736-1813). Y tampoco hay que olvidar que fue también en aquel siglo, en torno a 1780, cuando James Watt (1736-1819) introdujo sustanciales mejoras en las máquinas de vapor existentes, inaugurando una nueva era en la producción de energía mecánica, y dando origen de esta manera a la Revolución Industrial (terminó siendo la Primera Revolución Industrial), que cristalizó a partir de 1815, por lo que es en buena medida también un fenómeno decimonónico.
Pero de lo que yo quiero hablar aquí sobre todo es de Lavoisier y sus logros en la química, aunque para ello antes tengo que abordar otra cuestión.
Hay más «aires» de lo que parece
A lo largo de las tres primeras cuartas partes del siglo XVII, los químicos ampliaron el número de sustancias objeto de manipulación en el laboratorio, mejoraron los métodos para fabricar muchos productos de interés comercial y, este fue un desarrollo particularmente importante, lograron manejar e identificar «aires» distintos del aire común o atmosférico.
Hay que mencionar en este punto las aportaciones de diversos científicos. En primer lugar, las del médico de Bruselas Johannes Baptista Van Helmont (1577-1644), el creador de la palabra «gas» (puede que derive del término alemán Gascht, que denota la espuma que aparece tras la fermentación), quien, no obstante el misticismo que impregnaba sus investigaciones —fue seguidor de Paracelso—, observó que lo que denominó «gas silvestre» (muy probablemente dióxido de carbono; esto es, CO2), producido en las fermentaciones que tenían lugar en las fábricas de cerveza al igual que en otros tipos de trabajos (por ejemplo, al tratar mármol con un ácido, o al quemar piedra de cal), era de una especie diferente al «gas común», o atmosférico.
Otros nombres a recordar son:
(1) El clérigo anglicano Stephen Hales (1677-1761), uno de los primeros estudiosos de la nutrición y fisiología de plantas (véase, en este sentido, su libro Vegetable Staticks: or, an Account of some Statical Experiments on the Sap in Vegetables: Being an Essay towards a Natural History of Vegetation [Estática vegetal: o una descripción de algunos experimentos estáticos en la savia de vegetales: siendo un ensayo hacia una historia natural de la vegetación]; 2 vols., 1727, 1733). En el curso de sus investigaciones, Hales desarrolló técnicas e instrumentos especiales (como la «cuba neumática») para recoger y estudiar diferentes gases (los emitidos, por ejemplo, en la transpiración de las hojas), que consideraba diferentes al aire común.
(2) Henry Cavendish (1731-1810), un rico noble inglés, uno de cuyos entretenimientos era la química. Su principal descubrimiento en este campo fue que cuando se quema «aire inflamable» (nuestro hidrógeno) —cuyas propiedades estudió— en aire común, se produce agua.
(3) El escocés Joseph Black, autor de obras como Experiments upon magnesia alba, incluida en Essays and Observations, Physical and Literary (Ensayos y observaciones, físicos y literarios; 1754-1756), en la que señalaba con claridad que existían gases diferentes al gas común.
(4) Joseph Priestley (1733-1804), un personaje interesante donde los haya: nacido en Leeds, se dedicó al sacerdocio, como ministro no conformista. Fue predicador apasionado, tanto en religión como en lo que sus ideas políticas se refiere; ferviente admirador de la Revolución Francesa, en una ocasión en la que junto a unos amigos celebraba el aniversario de la toma de la Bastilla, su casa fue asaltada por la muchedumbre y su iglesia quemada, desapareciendo una buena parte de sus instrumentos y documentos científicos. Tuvo, en consecuencia, que emigrar a Norteamérica, instalándose en una población del estado de Pensilvania.
Como científico, su fama radica sobre todo en haber descubierto y aislado el oxígeno, que él denominó «aire desflogisticado», ya que era partidario de la teoría del flogisto, a la que me referiré enseguida (uno de sus escritos más importantes se titulaba The Doctrine of Phlogiston Established [La doctrina del flogisto establecida]; 1800). Expresado en términos analíticos, el hallazgo de Priestley —que difundió sobre todo en su libro Experiments and Observations on Different Kinds of Air (Experimentos y observaciones sobre diferentes tipos de aires; 1774)— se puede condensar en la reacción
cal de mercurio + calor → aire desflogisticado
esto es, calentó óxido de mercurio, obteniendo oxígeno.
Durante sus experimentos, Priestley encontró que las velas ardían con más brillo en presencia de su aire desflogisticado; también que los ratones —y él mismo— lo podían respirar sin ningún problema. He aquí como se refirió a este hecho en Experiments and Observations on Different Kinds of Air:
Mi lector no se sorprenderá de que, después de haberme asegurado de la superior cualidad del aire desflogisticado utilizando ratones y otras pruebas que ya he mencionado antes, tuviese la curiosidad de probarlo yo mismo. He satisfecho esta curiosidad respirándolo… El sentirlo en mis pulmones no es sensiblemente diferente de lo que sucede con el aire común, pero me dio la sensación de que mi respiración fue particularmente ligera y fácil durante algún tiempo después. ¿Quién puede decir si, en el futuro, este aire puro no se convertirá en un artículo de moda, en un lujo? Hasta el momento, sólo dos ratones y yo mismo hemos tenido el privilegio de respirarlo.
(5) Aunque estrictamente Priestley fue el primero en anunciar el descubrimiento del gas (y elemento químico) que terminó siendo denominado oxígeno, otro científico que hay que mencionar es el sueco Carl Wilhelm Scheele (1742-1786), quien parece que llegó antes a este resultado, cuando entre 1770 y 1773 calentó pirolusita (dióxido de manganeso) con ácido sulfúrico concentrado, dando origen a la siguiente reacción, en la que se producía oxígeno (para él, «aire de fuego»)
2 MnO2 + 2 H2SO4 → 2 MnSO4 + 2 H2O + O2
Sin embargo, la publicación de sus resultados (en un libro que tituló Chemische Abhandlung von der Luft und dem Feuer [Tratados sobre el aire y el fuego], que apareció en 1777) se demoró dos años, mientras esperaba recibir el prólogo del mineralogista Torbern Bergman (1735-1784), permitiendo así la prioridad de su colega inglés.
A pesar de avances como éstos, ninguno de los filósofos naturales involucrados consiguieron crear para la química un sistema teórico basado en el método experimental, ni elaborar un lenguaje metódico y preciso que sirviera de eficaz instrumento de comunicación. La química era, en consecuencia, una de las ciencias cuyo reflejo en la Encyclopédie aparecía como menos brillante. Gabriel-François Venel (1723-1775), redactor de la mayor parte de las voces químicas de aquella obra magna, ofrecía en el volumen tercero (1753) una panorámica bastante pesimista del desarrollo alcanzado por su disciplina al coronarse la primera mitad del siglo. Para Venel, el remedio consistía en que llegase un día en el que un buen químico revolucionase esta ciencia y la situase a la altura de las demás: «Esta revolución, digo, no puede ser realizada más que por un químico hábil, entusiasta y atrevido que, al encontrarse en una situación favorable y aprovechar hábilmente algunas circunstancias felices, sepa despertar la atención de los sabios, primero con una ostentación brillante, con un tono decidido y afirmativo, y después con argumentos si sus primeras armas hubieran atacado el prejuicio».
Los deseos de Venel no tardarían en cumplirse: Antoine-Laurent de Lavoisier (1743-1794) se llamaría el químico «hábil, entusiasta y atrevido».
Lavoisier
Como señalé con anterioridad, Lavoisier compendia toda la grandeza y tragedia de la Ilustración. Hijo de un próspero abogado de París, estudió Derecho como su padre, aunque desde el primer momento mostró interés por la ciencia, cuyos estudios compaginó con los legales (antes incluso de obtener el título de abogado, escribió —en 1763— su primer trabajo científico: sobre una aurora boreal observada en Villers Cotterets). Especialmente importante es el año de 1768, cuando fue elegido «adjunto supernumerario» de la Académie des Sciences e inició su actividad en la Ferme Générale, una de las principales instituciones existentes en el Antiguo Régimen para recoger impuestos. Se trataba de una organización financiera privada (lo que hizo Lavoisier para entrar en ella fue comprar un tercio de una participación), cuyo nombre podríamos traducir como Compañía General de Arrendatarios. Como arrendatario (férmier), Lavoisier estaba obligado a realizar giras de inspección (por este motivo pasó fuera de París la mayor parte de 1769 y 1770) e informar de sus observaciones a los directores de la Compañía, férmiers más veteranos como Jacques Paulze, con cuya hija Marie Anne Pierrette Paulze (1758-1836) se casó en 1771, cuando Anne tenía sólo 13 años. No fue, está claro, no pudo ser, un matrimonio por amor, sino uno de tantos organizados por motivos o conveniencias diversos, lo que no quiere decir que la unión no diese frutos satisfactorios en este caso (en lo que se refiere a la ciencia, Anne se convertiría en una buena ayudante de su esposo). El mismo año de su matrimonio, Lavoisier incrementó su participación en la Ferme Générale: con una inversión de 780.000 francos, una fortuna desde luego.

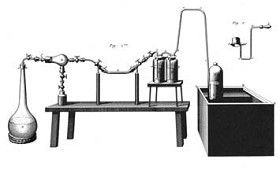
Lámina de «Observations on differents kinds of air» (Philosophical Transactions of the Royal Society, 1772; también aparece en el libro titulado Experiments and Observations on Differents Kinds of Air, publicado en 1774), de Joseph Priestley, que representa uno de sus experimentos para demostrar los efectos de la combustión, putrefacción y respiración en una planta de menta (a la dcha.) y en ratones (en la parte delantera).

Lavoisier, según un grabado de Mlle. Brossard-Beaulieu.
No es, por supuesto, la presente ocasión para tratar la cuestión del sistema impositivo galo, importante para entender el derrumbamiento de la monarquía absoluta francesa. Recordaré únicamente unos datos que son necesarios para comprender mejor la biografía de Lavoisier: en la tradición medieval, los soberanos no tenían ningún derecho a gravar a sus súbditos de modo permanente; los impuestos eran considerados expedientes temporales y excepcionales para poner remedio a situaciones críticas. Fue a mediados del siglo XVI cuando se creó en Francia una categoría de «impuestos ordinarios», que, sin embargo, gravaban en general sólo a los miembros serviles y no privilegiados de la sociedad. Pero no era el rey quien recolectaba los impuestos, sino grupos privilegiados intermedios, entre los que se encontraban los arrendatarios generales, que se convirtieron en una de las principales fuentes de crédito del Gobierno, al que adelantaban fondos, a cambio de deducciones de interés sobre el montante de los contratos futuros; también emitían billets des fermes a corto plazo, documentos de crédito destinados al público. ¿Sorprenderá que en el juicio que terminó con su condena a muerte, Lavoisier estuviese acompañado por otros 25 férmiers (uno de los cuales fue, por cierto, su suegro)?, ¿que, de hecho, aquel fuese en realidad un juicio contra la Ferme Générale?: «Todos los arrendatarios generales presentes —se lee en el texto de la sentencia (firmado el 19 floreal del año II, esto es, el 8 de mayo de 1794)— han sido traídos ante el tribunal revolucionario para ser juzgados conforme a la ley de delitos de dilapidación de las rentas del gobierno, conculcaciones y abusos, fraudes hacia el pueblo, traiciones hacia el gobierno y otras de las que han sido advertidos». Pero dejemos esto por el momento, ya que todavía no hemos llegado a la muerte de Lavoisier, y continuemos con otros detalles de su biografía.
Como buen ilustrado, Lavoisier no fue nunca ajeno a la actividad pública, un interés que en su caso se manifestó, al margen de su actividad como férmier, de al menos dos formas: una, con trabajos en lo que hoy denominaríamos «ciencia aplicada» (ya en 1766, concursó al premio convocado por la Académie des Sciences con una memoria sobre el alumbrado público); otra, a través de los cargos públicos que ocupó: en 1775 fue nombrado uno de los cuatro directores de la Régie des Poudres (la Administración de Pólvora), la institución estatal encargada de la producción de pólvoras y salitres, puesto que mantuvo hasta 1791; en 1787 fue elegido representante del Tercer Estado en la Asamblea Provincial de Orléans, y en 1789 diputado suplente por la nobleza de Bois en los Estados Generales y miembro de la Comuna de París.
Y ahora sí, es el momento de pasar a resumir sus principales contribuciones a la química.
La química de Lavoisier
En los años finales de la década de 1760, Lavoisier se sumió en investigaciones encaminadas a determinar el grado de pureza que el agua —uno de los protagonistas principales de su obra— podía alcanzar mediante destilaciones repetidas. Esto le llevó a plantearse uno de los problemas que ocupaban la atención de los químicos: la transmutación del agua en tierra. Recordemos una vez más que todavía estaba extendida entre los químicos la creencia en la teoría aristotélica de los cuatro elementos —agua, tierra, aire y fuego—, que por sus cualidades comunes podían transformarse unos en otros: el agua (fría y húmeda) podía transmutarse en tierra (fría y seca). Las medidas de densidades de muestras de agua en función de las materias disueltas, le hicieron sospechar que el depósito terroso que se formaba en destilaciones (recurriendo al calor aportado por el fuego) sucesivas de una muestra de agua, cuya densidad no variaba apreciablemente en las últimas destilaciones, era un producto de las operaciones realizadas. Para dilucidar el problema, Lavoisier pensó, correctamente, que el único medio de comprobar su hipótesis era repetir las experiencias en recipientes herméticamente cerrados, con la precaución de tomar cuenta exacta del peso del recipiente y del agua empleados. Si el peso total, finalizada la experiencia, no variaba, «entonces necesariamente debía encontrarse una disminución de peso en una u otra de estas dos sustancias [el agua y el recipiente], y esta disminución debía ser precisamente igual a la cantidad de tierra separada». Si, por el contrario, el peso del conjunto aumentaba al final, entonces la «materia del fuego» que pasaba a través del vidrio y se combinaba con el agua, era la responsable de tal aumento.

Georg Stahl, según un grabado en Opusculum chimico-physicomedicum (Nuremberg, 1715).
Lavoisier pesó cuidadosamente (en este sentido para él fue tan importante la balanza como el matraz) un recipiente de vidrio y el agua que introdujo en él; lo cerró herméticamente y puso a hervir el agua por espacio de 101 días consecutivos. A medida que transcurría el tiempo, se formaba un residuo terroso. Una vez retirado el aparato del fuego, anotó de nuevo el peso del conjunto (recipiente y agua) y observó que no había variado. Comprobó entonces, en contra de la opinión común, que el fuego no producía ningún aumento de peso. Después pesó el residuo seco e hizo lo mismo con el recipiente. El peso del residuo era prácticamente igual a la pérdida de peso experimentada por el recipiente, por lo que concluyó que el depósito terroso procedía del vidrio y no del agua. Como vemos, en un campo diferente, Lavoisier estaba socavando el universo aristotélico, al igual que más de un siglo antes lo había hecho Galileo con sus observaciones astronómicas.
Aunque no lo he dicho explícitamente, los procedimientos y conclusiones precedentes se basaban en una convicción que para nosotros es, en la actualidad (ampliada un tanto, de manera que incluya también la energía), casi un lugar común, pero que no lo era para los químicos de su época: la de la ley de la conservación de la masa, ley que Lavoisier no formularía explícitamente hasta la publicación de su Tratado elemental de química (1789). En efecto, en el capítulo XIII («De la descomposición de los óxidos vegetales por la fermentación viscosa»), podemos leer:
Para llegar a la solución de estos problemas, está claro que haría falta conocer primero el análisis y la naturaleza de los cuerpos susceptibles de fermentar y los productos de la fermentación; porque nada se crea, ni en las operaciones del arte, ni en las de la naturaleza, y se puede sentar como principio que, en toda operación, hay una cantidad igual de materia antes y después de la operación, que la cualidad y cantidad de los principios es la misma, y que no hay más que cambios y modificaciones.
Todo el arte de hacer experiencias en química está fundado sobre este principio: hay que suponer en todos los experimentos una verdadera igualdad o ecuación entre los principios del cuerpo que se examina y los que se sacan por el análisis.
Hoy recordamos esta contribución con la sencilla y un tanto burda expresión: «nada se crea ni se destruye».
Pasando ahora a otro aspecto de la revolución química asociada con el nombre de Lavoisier, tenemos que en ella el oxígeno desempeñaba un papel central. La combustión, uno de los procesos más notorios que se dan en la naturaleza y que ahora los diccionarios definen como «reacción química entre el oxígeno y un material oxidable, acompañada de desprendimiento de energía», pasó gracias a él a explicarse de una forma bien distinta a como se hacía en la teoría más influyente de la química precedente: la teoría del flogisto.
Según esta teoría, la capacidad que tiene un cuerpo para arder se debe a la existencia en su composición de una determinada sustancia llamada flogisto (del griego filox, esto es, «llama»; por consiguiente, literalmente «principio de la llama»), nombre que le dio su creador, Georg Stahl, médico del rey de Prusia y autor de obras como Fundamenta chymiae dogmaticae & experimentalis (Fundamentos de químicas dogmática y experimental; 1723). Igualmente, para que un metal llegara a calcinarse (de acuerdo con la visión actual, la calcinación es la transformación por oxidación de un metal a su mineral o cal), era indispensable que el flogisto formara parte de su composición.
En estas dos operaciones, combustión y calcinación, básicas dentro de la química, tenía lugar el mismo proceso: el desprendimiento de flogisto de las sustancias que lo contenían. Cuando la combustión y la calcinación se llevaban a cabo en recipientes cerrados, llegaba un momento en que el proceso se detenía; la teoría explicaba este hecho postulando que el aire contenido en el recipiente se saturaba del flogisto desprendido durante la operación y no admitía más adiciones. Por tanto, un metal no era una sustancia simple, sino que estaba compuesto por dos más simples: el flogisto y la tierra o ceniza que quedaba después de la calcinación, esto es, la «cal» del metal.
A comienzos de la década de 1770, Lavoisier emprendió sus investigaciones sobre el papel que desempeñaba el aire en el proceso de la combustión. A finales de 1772 ya pudo demostrar que tanto el fósforo como el azufre se combinaban con el aire durante la combustión, y que los productos que se producían (los ácidos fosfórico y sulfúrico) pesaban más que el fósforo y el azufre iniciales. Se trataba, por consiguiente, de un proceso de adición, en lugar de uno en el que se producía un desprendimiento (de flogisto). A lo largo de los dos años siguientes comprobó que la calcinación era un proceso similar a la combustión; esto es, que cuando un metal se calcinaba se unía a una parte del aire circundante, aumentando de peso. En octubre de 1774, el ya citado Joseph Priestley comunicó a Lavoisier que había estudiado recientemente un gas particular que era mucho más apto que el «aire común» para mantener la combustión. Por esta razón, le había dado el nombre de «aire desflogisticado», porque podía recibir mucho flogisto favoreciendo la combustión de otros cuerpos. Lavoisier pronto comprendió el papel fundamental que este nuevo gas desempeñaba en los procesos químicos de la combustión y la calcinación, que pasaron a convertirse en fenómenos que implicaban la absorción o combinación de un nuevo elemento, un aire al que bautizaría, como veremos enseguida, con el nombre de oxígeno. A partir de entonces, el aire común o atmosférico no fue ya una sustancia simple, sino que se compuso de dos o más elementales. En particular, Lavoisier demostró que estaba formado por dos gases, uno —el «aire vital»— que sostenía la combustión, y otro «ázote», o «ázoote» (nitrógeno), que no.
Tampoco el agua, el más universal componente de la naturaleza, superó indemne el paso de la vieja a la nueva química. Al igual que el aire atmosférico, dejó de ser considerada como una sustancia simple, logro en el que, como vimos, participó Henry Cavendish. «Hasta nuestros días —escribió Lavoisier en su Tratado elemental de química, en donde explicó el procedimiento que había seguido en este descubrimiento (que publicó en 1781)—, el agua se había considerado como un cuerpo simple, y los antiguos no tuvieron dificultad alguna en llamarla elemento. Para ellos era, sin duda, una sustancia elemental, puesto que no habían conseguido descomponerla o, al menos, porque las descomposiciones del agua que tenían lugar diariamente ante su vista escapaban de sus observaciones. Pero ahora… el agua ya no es para nosotros un elemento.»

Lavoisier y su esposa; retrato pintado por Jacques-Louis David en 1788 (Metropolitan Museum of Art, Nueva York).
Una nueva nomenclatura
Nos ha aparecido hace un instante la cuestión de la terminología. Y es importante detenerse en ella, ya que una parte básica de la revolución química asociada al nombre de Lavoisier tiene que ver con el desarrollo de una nueva nomenclatura. Hasta entonces se había dado un nombre arbitrario a las sustancias identificadas, nombres como vitriolo de estaño, álcali flogisticado, flor de arsenio, agua mercurial, alumbre nitroso, sal de Júpiter o polvos del conde de Palma de Santinelli; además, un mismo compuesto podía ser denominado de muchas formas diferentes (el caso, por ejemplo, del carbonato sódico, que recibió como nombres —empleando los términos del castellano de finales del siglo XVIII—: natrum o natrón, base de sal marina, alkali marino, alkali mineral, cristales de sosa, sosa gredosa, sosa ayreada, sosa efervescente, mefite de sosa, alkali fijo, mineral ayreado, alkali mineral efervescente, greda de sosa y barrilla). La asociación, en 1787, de Lavoisier con Guyton de Morveau (1737-1816), Claude Louis Berthollet (1748-1822) y Antoine François de Fourcroy (1755-1809) para compilar un Méthode de nomenclature chimique (Método de nomenclatura química), significó un paso decisivo en la racionalización de la química. Más aún, la nueva química, el edificio teórico que Lavoisier estaba construyendo, necesitaba para su consolidación elaborar un idioma propio, que fuese metódico y preciso.
En una época como es la nuestra en la que, en dominios cada vez más extensos los lenguajes, los idiomas, se degradan, siendo objeto de un descuido tal que más cabría emplear la expresión «desprecio», merece la pena recordar algunas de las manifestaciones que Lavoisier empleó al presentar la nueva nomenclatura química en una Junta pública de la Academia de Ciencias parisina celebrada el 18 de abril de 1787 («Sobre la necesidad de perfeccionar y reformar la nomenclatura de la química»):
Las lenguas no sólo tienen por objeto, como se cree comúnmente, expresar por signos las ideas e imágenes; sino que además son verdaderos métodos analíticos, con cuyo auxilio procedemos de lo conocido a lo desconocido, y hasta cierto punto, al modo de los matemáticos: probemos a aclarar esta idea.
El álgebra es por excelencia el método analítico: fue inventado para facilitar las operaciones del alma, para abreviar el paso del raciocinio, para incluir en pequeño número de líneas lo que hubiera necesitado muchas páginas de disputa; finalmente, para conducir con más comodidad, prontitud y seguridad a la solución de las cuestiones más complicadas. Pero un solo instante de reflexión convence fácilmente que el álgebra es una verdadera lengua: así como todas, tiene sus signos representativos, su método, su gramática, si se nos permite valernos de esta expresión: según esto, un método analítico es una lengua; una lengua es un método analítico, y estas expresiones son en cierta manera sinónimas.
La nueva química que él había diseñado necesitaba de todo esto. Necesitaba purificarse a través del lenguaje: «una lengua bien hecha y en la que se haya verificado el orden sucesivo y natural de las ideas, ocasionará una revolución necesaria y aun pronta en el modo de enseñar; no permitirá a los profesores apartarse de los pasos de la naturaleza; será preciso, o no admitir la nomenclatura o seguir sin remisión el camino que ella haya manifestado».
No resisto en este punto recordar un escrito poco conocido de Pedro Salinas. Es, ya lo sé, una pequeña digresión, pero, al fin y al cabo, el historiador debe ser algo más que un narrador y notario de historias; debe aprovechar cualquier momento para intentar hacer mejores a quienes lo leen o escuchan, que así también será mejor él mismo. El escrito en cuestión, lavoisieriano me atrevo a decir, de Salinas se titula Defensa del lenguaje. «El lenguaje es necesario al pensamiento —señalaba allí el poeta—, le permite cobrar conciencia de sí mismo. Y así se construye el objeto, en respuesta a la expectación del espíritu. El pensamiento hace el lenguaje, y al mismo tiempo se hace por medio del lenguaje… El pensamiento se orienta hacia el lenguaje como hacia el instrumento universal de la inteligencia.» Y, bastante más adelante, concluía su hermoso texto con un «Llamamiento» que nunca como hoy es tan necesario: «este discurso quiso ser un llamamiento a todos para que dediquen a su lengua el amor que se merece, para que vigilen su estado, sus pasos; para que la cuiden tal como nos la cuidaron los que desde siglos atrás vienen transmitiéndonosla… Este lenguaje que hablamos, nuestro es por unos años, recibido lo tenemos de los hombres de ayer, en él están, apreciables, todos los esfuerzos que ellos pusieron en mejorarlo. Pues bien, este es mi llamamiento: que cuando nosotros se lo pasemos a nuestros hijos, a las generaciones venideras, no sintamos la vergüenza de que nuestras almas entregan a las suyas un lenguaje empobrecido, afeado o arruinado. Este es el honor lingüístico de una generación humana, y a él apelo en estas mis últimas palabras».

Lavoisier en su laboratorio, experimentando sobre la respiración de un hombre en reposo (dibujo de Marie Anne Lavoisier, que aparece a la derecha, sentada, tomando notas).
Pienso que Lavoisier habría suscrito lo que manifestó Salinas. En realidad, en lo que él mismo escribió se encuentran las mismas ideas; ideas de amor y de rigor hacia el idioma.
Pero dejemos esta digresión y volvamos a la nueva nomenclatura química introducida por Lavoisier y sus colegas.
En cuanto a las normas introducidas por los químicos franceses, yo me atrevería a caracterizarlas como un ejercicio de lógica y sentido común. Entre sus supuestos metodológicos figuran que los nombres debían conformarse lo más estrechamente posible con las sustancias a las que designasen, que los cuerpos compuestos de otros más simples recibiesen nombres que expresasen su composición, mientras que los últimos recibiesen denominaciones sencillas; que los epónimos (que dan nombre a un pueblo, a una época, etc.) quedasen proscritos y que se utilizasen nombres con raíces procedentes de lenguas muertas bien conocidas que permitiesen recordar la palabra por su significado y viceversa. Recurriendo de nuevo al Tratado elemental de química (Primera parte, capítulo IV: «Nomenclatura de las diferentes partes constituyentes del aire atmosférico»):
Las palabras nuevas las hemos tomado principalmente del griego de tal forma que sus etimologías evocasen la idea de las cosas que nos proponíamos expresar y sujetándonos, sobre todo, a no admitir más que las palabras más cortas posibles que fuesen susceptibles de formar adjetivos y verbos.
Según estos principios y siguiendo el ejemplo de Macquer, hemos conservado el nombre de gas usado por Vanhelmont [Van Helmont] para denominar a la clase numerosa de fluidos elásticos aeriformes, con excepción del aire atmosférico. Por tanto, la palabra gas es para nosotros un nombre genérico que designa el último grado de saturación de cualquier sustancia por el calórico, es decir, la expresión de uno de los estados en que se pueden presentar los cuerpos. Para explicar después cada especie de gas, hemos agregado un segunda palabra tomada del nombre de la base…
Se ha visto que el aire atmosférico estaba formado principalmente por dos fluidos aeriformes o gases, uno respirable donde pueden vivir los animales, calcinarse los metales y arder los cuerpos combustibles, y otro con propiedades totalmente opuestas donde los animales no pueden respirar, ni mantenerse la combustión, etc. A la base de la parte respirable del aire le hemos dado el nombre de oxígeno, derivándolo de dos vocablos griegos, o’ξύς, ácido, y γείνομαι, yo engendro, porque, en efecto, una de las propiedades más generales de esta base es la de formar ácidos al combinarse con la mayor parte de las sustancias… Como las propiedades químicas de la parte no respirable del aire atmosférico no se conocen aún bien, nos hemos contentado con deducir el nombre de su base de la propiedad que tiene este gas de quitar la vida a los animales que lo respiran, llamándole ázoe [ahora nitrógeno], de la α privativa de los griegos y de ζωή, vida.
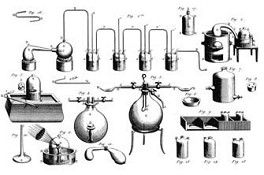
Dos grabados incluidos en el Traité élémentaire de chimie (1789), de Lavoisier.
Esto es, «oxí-geno» porque se trataba, según él, de un «generador de ácido»; ázoe, porque privaba de vida, «hidró-geno» por ser un «generador de agua».
Hay que hacer notar que la nueva nomenclatura presuponía, naturalmente, que la teoría del oxígeno era cierta. Así, se eligió la raíz ico para utilizar en sustancias en las que predominase el oxígeno; mientras que la terminación oso era para añadir a aquellas en las que la proporción de oxígeno fuese menor. Este hecho creó resentimiento entre los adversarios de la teoría lavoisieriana, sin dejar de lado la circunstancia de que químicos ya establecidos se vieran forzados a aprender un aspecto básico de su disciplina desde el principio. He aquí un signo genuino de una revolución: el tener que aprender de nuevo la disciplina.
Otro apartado importante a la hora de hablar de «revoluciones» (científicas, al igual que de cualquier otro tipo) es el desarrollo de medios propios para difundir las ideas que caracterizan al nuevo movimiento. En el caso de la química de Lavoisier, este medio fue una revista dedicada de manera casi exclusiva a ella: los Annales de Chimie, fundada en 1789. No es sorprendente que el equipo editorial de la revista estuviera formado por defensores de la nueva química: Guyton y Lavoisier, como editores principales, y Gaspard Monge, Berthollet, Fourcroy, Jean de Dietrich y Jean-Henri Hassenfratz. La nueva revista no era, desde luego, la única publicación que aceptaba trabajos de química en Francia: estaban, por ejemplo, las prestigiosas Mémoires de la Académie des Sciences, pero esta publicación tardaba con frecuencia entre dos y tres años en publicar los trabajos. Los Annales de Chimie contaban con la importante ventaja de ser mucho más rápidos en publicar los trabajos recibidos, además de aparecer con mayor frecuencia que las Mémoires.
El Tratado elemental de química y la Revolución
La ciencia revolucionaria se convierte en «ciencia normal» (recurriendo por una vez a la terminología de Thomas Kuhn) cuando llega a los libros de texto en los que aprenden las nuevas generaciones de estudiantes. No todas las revoluciones científicas están vinculadas con un libro que, inicialmente al menos, cumple tales funciones, pero algunas —y de las más importantes— sí. Almagesto de Ptolomeo, los Principia de Newton, los Elementos de geología de Lyell, El origen de las especies de Darwin y el Tratado de electricidad y magnetismo de Maxwell son algunas de esas obras. Y, por su supuesto, el Tratado elemental de química de Lavoisier.
Ya me he referido en varias ocasiones a esta obra, pero ahora sólo quiero recordar un dato: el año de su publicación. Fue porque en ellos se publicaron los Principia, los Principios de geología o El origen de las especies que muchos, o algunos, de nosotros recordamos los años de 1687, 1830-1833 o 1859. Por nada más. No sucede lo mismo con el Traité élémentaire de chimie, presenté dans un ordre nouveau et d’après les decouvertes modernes (Tratado elemental de química, presentado en un orden nuevo según los descubrimientos modernos), que vio la luz en 1789, el mismo año en que, el 14 de julio, masas parisinas tomaron la Bastilla, el odiado símbolo de un régimen que ya no se quería —que acaso nunca fue querido—, poniendo en marcha de esta manera la Revolución Francesa. Lavoisier, entonces en la cumbre de su poder y prestigio, científico y público, no pudo permanecer al margen de aquel confuso y con frecuencia contradictorio proceso, en el que las ansias de libertad e igualdad a menudo se combinaron con la crueldad, el vandalismo y el Terror, el Terror con mayúscula. Difícilmente, por otra parte, podría haberlo hecho; su vida, al fin y al cabo, era como un tejido fina, sólidamente unido al mundo social, a la sociedad, al pueblo en definitiva (aunque él, como otros aristócratas de entonces, de antes y de después, no supiese calibrar lo que esto significaba). Y, como ha señalado uno de sus biógrafos (Arthur Donovan, Antoine Lavoisier. Science, Administration and Revolution; 1993), a partir de aquel momento su historia es sencilla: «se vio aprisionado por sucesos que ni él ni nadie pudo haber anticipado o controlado». De nada le sirvió todo su prestigio, todo su poder. En una nota que escribió durante los meses que pasó en prisión, Lavoisier defendió —refiriéndose a sí mismo en tercera persona— con orgullo su carrera como científico y ciudadano:
Lavoisier, miembro de casi todas las academias de Europa, ha consagrado su vida principalmente a trabajos relativos a la física y a la química.
Durante los veinticinco años que ha sido miembro de la Academia de Ciencias, ha hecho imprimir en sus Actas más de 80 memorias, de las que una gran parte contienen descubrimientos importantes para las artes, las ciencias y la humanidad. Ha consagrado a este fin una parte importante de su fortuna.
Se ha ocupado principalmente de experimentos de agricultura muy onerosos que ha continuado durante quince años y en los cuales ha sacrificado más de 120.000 libras; se propone incesantemente publicar una obra importante sobre este tema.
No esperó en ningún momento la época de la Revolución para manifestar sus principios sobre la libertad y la igualdad.
Seguramente creía lo que escribió. Que había amado la libertad y la igualdad siempre. Sólo que la libertad e igualdad de los férmiers généraux no eran, claro, la libertad e igualdad del pueblo llano, de los sans-culottes que tomaron la Bastilla el mismo año que se publicó su Tratado elemental de química, una obra que, como la Revolución, también contribuyó a cambiar el mundo, pero que ellos, los revolucionarios que se unieron en la entrada del suburbio de Saint-Antoine para marchar hacia la Bastilla, no habían leído, entre otros motivos porque muchos —la mayoría seguramente— no sabían leer.
Y así su cabeza cayó segada por la guillotina el 8 de mayo de 1794, junto a otros veintiocho acusados de conspirar contra el pueblo de Francia. «Sólo un instante para cortar esa cabeza. Puede que cien años no basten para darnos otra igual», se cuenta que dijo Lagrange.
El día antes del ajusticiamiento, Lavoisier escribió a su primo Augez de Villers que «había disfrutado de una vida razonablemente larga, y de bastante éxito, y creo que mi memoria será acompañada con algunos lamentos, acaso con alguna gloria. ¿Qué más podría haber deseado pedir? Los sucesos de los que me encuentro rodeado probablemente me evitarán los inconvenientes de la vejez».
Fue, como vemos, el suyo un final digno, con un toque de fina ironía e, inevitablemente, melancolía. Un final que no impidió —no lo impide nunca— que la ciencia a la que se había dedicado con pasión continuase progresando.
Apéndice
A. L. de Lavoisier, «Discurso preliminar» del Tratado elemental de química:
La imposibilidad de aislar la nomenclatura de la ciencia y la ciencia de la nomenclatura, se debe a que toda ciencia física se forma necesariamente de tres cosas: la serie de hechos que constituyen la ciencia, las ideas que los evocan y las palabras que los expresan. La palabra debe originar la idea, ésta debe pintar el hecho: he aquí tres huellas de un mismo cuño. Y como las palabras son las que conservan y transmiten las ideas, resulta que no se puede perfeccionar la lengua sin perfeccionar la ciencia, ni la ciencia sin la lengua; y por muy ciertos que fuesen los hechos, por muy justas que fuesen las ideas que originasen, sólo transmitirán impresiones falsas si careciésemos de expresiones exactas para nombrarlos.
Aquellos que lean con atención la primera parte de este tratado encontrarán repetidamente comprobadas estas verdades; pero, como me he visto forzado a seguir en él un orden diametralmente distinto al que se ha adoptado hasta el momento en todas las obras de química, manifestaré los motivos que he tenido para ello.
Es un principio constante, cuya generalidad está bien verificada tanto en las matemáticas como en los demás saberes, que para instruirnos debemos pasar siempre de lo conocido a lo desconocido. Durante la primera infancia nuestras ideas proceden de nuestras necesidades, la sensación de éstas origina la idea de los objetos apropiados para satisfacerlas, y por una serie de sensaciones, observaciones y análisis, se genera de forma insensible una sucesión de ideas ligadas entre sí, donde un observador atento puede, hasta cierto punto, encontrar el hilo y encadenamiento, que constituyen el conjunto de nuestro saber.
Cuando nos disponemos por primera vez a realizar el estudio de una ciencia, nos encontramos con relación a ella en un estado muy similar a aquel en que se hallan los niños, y el camino que debemos seguir es precisamente el que sigue la naturaleza en la formación de sus ideas. Así como en el niño la idea es un efecto de la sensación, y es ésta quien produce la idea, de la misma forma para aquel que se dispone a iniciar el estudio de las ciencias físicas, las ideas no deben ser más que una consecuencia, el resultado inmediato de una experiencia o una observación.
Séame permitido añadir que la situación del que entra en la carrera de las ciencias es menos ventajosa que la del niño que adquiere sus primeras ideas; si éste se engaña respecto a los efectos saludables o nocivos de los objetos que le rodean, la naturaleza le suministra multiplicados medios para rectificar. Cualquier juicio que forme se ve a cada instante corregido por la experiencia. La privación o el dolor suceden a un juicio falso; la alegría y el placer a un juicio adecuado. No se tarda con tales maestros en llegar a ser consecuentes y pronto se razona de forma justa cuando no puede hacerse de otro modo bajo pena de privación o sufrimiento.
No ocurre igual en el estudio y práctica de las ciencias: los juicios falsos que formamos no involucran a nuestra existencia y bienestar. Por el contrario, la imaginación que siempre tiende a llevarnos más allá de los límites de la verdad, el amor propio y la confianza que nos inspira en nosotros mismos, nos inducen a sacar consecuencias que no se derivan inmediatamente de los hechos; de suerte que parecemos estar, de algún modo, interesados en seducirnos. No es extraño, pues, que en las ciencias físicas, en general, se hayan comúnmente realizado conjeturas en lugar de conclusiones, que estas conjeturas al transmitirse de época en época hayan llegado a ser cada vez más dominantes por el peso de la autoridad que adquirieron y que, en fin, hayan sido adoptadas y consideradas como verdades fundamentales incluso por hombres de gran inteligencia.
Para evitar estos desvaríos, el único medio consiste en suspender o, al menos, simplificar todo lo posible el razonamiento que, por proceder de nosotros, solamente él puede engañarnos; en someterlo continuamente a la prueba de la experiencia; en no conservar más que los hechos que son datos de la naturaleza y no pueden equivocarnos, en no buscar la verdad más que en el encadenamiento natural de las experiencias y observaciones, al igual que los matemáticos llegan a la solución de un problema por la simple ordenación de los datos, reduciendo el razonamiento a operaciones tan sencillas, a juicios tan breves, que nunca pierdan de vista la evidencia que les sirve de guía.
Convencido de estas verdades, me he impuesto la ley de no pasar nunca más que de lo conocido a lo desconocido, de no deducir ninguna consecuencia que no se derive inmediatamente de las experiencias y observaciones, y de encadenar los hechos y verdades químicas en el orden más apropiado que facilite la comprensión a los principiantes. Pero al sujetarme a este plan era imposible que no me desviase de los caminos ordinarios. Pues es un defecto común a todos los cursos y tratados de química suponer desde la primera lección que el alumno o el lector poseen unos conocimientos que sólo podrán adquirir en las lecciones siguientes. En casi todos ellos se empieza por hablar de los principios de los cuerpos y explicar la tabla de afinidades, sin advertir que por ese camino es necesario recorrer desde el primer día los principales fenómenos de la química, utilizar expresiones que no han sido definidas aún y suponer ya formados en esta ciencia a quienes se trata de enseñarla. Igualmente es un hecho que sólo se aprende poca cosa en un primer curso de química, que un año apenas es suficiente para familiarizar el oído con la terminología, la vista con los aparatos, y que es casi imposible formar un químico en menos de tres o cuatro años.
Como estos inconvenientes se deben más a la naturaleza de las cosas que a la forma de la enseñanza, me he impuesto dar a la química un rumbo que me parece más conforme con el que sigue la naturaleza. No se me oculta que al querer evitar un género de dificultad me meta en otro y que me sería imposible superarlas todas, pero creo que las que queden por allanar no se deben al orden que me he propuesto, sino que son más bien consecuencia del estado de imperfección en que aún se encuentra la química. Esta ciencia presenta numerosas lagunas que interrumpen la serie de los hechos y que exigen enlaces embarazosos y difíciles. No tiene la ventaja, como la geometría elemental, de ser una ciencia completa cuyas partes están todas ligadas entre sí, pero, sin embargo, su marcha actual es tan rápida y los hechos se adecuan tan satisfactoriamente a la doctrina moderna, que podemos esperar verla, incluso en nuestros días, muy cerca de alcanzar el grado de perfección de que es susceptible.
Esta ley rigurosa que no debo transgredir, de no deducir nada más allá de lo que las experiencias muestren, de no suplir nunca lo que los hechos silencien, no me ha permitido incluir en esta obra aquella parte de la química más susceptible quizá de llegar a ser un día una ciencia exacta: la que trata de las afinidades químicas o atracciones electivas. Geoffroy, Gellert, Bergman, Scheele, Morveau, Kirwan y muchos otros ya han reunido una multitud de hechos singulares a los que sólo falta colocarlos en sus lugares correspondientes. Pero no tenemos aún datos básicos o, al menos, los que poseemos no son lo bastante precisos y exactos todavía como para que puedan llegar a ser el apoyo fundamental sobre el que descanse una parte tan importante de la química. Por otra parte, la ciencia de las afinidades es a la química ordinaria lo que la geometría superior a la geometría elemental, y he creído que no debía complicar con grandes dificultades unos elementos sencillos y fáciles que serán comprendidos, espero, por un gran número de lectores…
No dejará de extrañar que en un tratado elemental de química no aparezca un capítulo sobre las partes constituyentes y elementales de los cuerpos, pero he de advertir aquí que la manía que tenemos de que todos los cuerpos naturales se compongan únicamente de tres o cuatro elementos se debe a un prejuicio heredado de los filósofos griegos. Admitir que cuatro elementos componen todos los cuerpos conocidos sólo por la diversidad de sus proporciones es una mera conjetura imaginada mucho antes de que se tuviesen las primeras nociones de la física experimental y de la química. Se carecía aún de hechos y sin ellos se creaban sistemas, y hoy que los poseemos parece que nos empeñamos en rechazarlos cuando no se adaptan a nuestros prejuicios; tan es así que aún se deja sentir el peso de la autoridad de los padres de la filosofía humana y que sin duda continuará pesando sobre las generaciones venideras.
Es digno de señalar que ninguno de los químicos partidarios de la doctrina de los cuatro elementos no haya admitido, forzado por los hechos, un mayor número de ellos. Los primeros químicos que escribieron después de la renovación de las letras, consideraron el azufre y la sal como sustancias elementales que entraban en la composición de gran número de cuerpos y así reconocieron la existencia de seis elementos en vez de cuatro. Becher admitía tres tierras, de cuya combinación en proporciones distintas deducía la diferencia existente entre las sustancias metálicas. Stahl modificó este sistema y todos los químicos que le han sucedido se han permitido imaginar o introducirle algunos cambios; pero todos ellos se han dejado arrastrar por la mentalidad de su época que se contentaba con aserciones sin pruebas o, al menos, consideraba como tales las probabilidades menos fundadas.
Todo lo que puede decirse sobre el número y naturaleza de los elementos se reduce, en mi opinión, a puras discusiones metafísicas; sólo se intenta resolver problemas indeterminados susceptibles de infinitas soluciones, ninguna de las cuales, con toda probabilidad, será acorde con la naturaleza. Me contentaré, pues, con decir que si por el nombre de elementos queremos designar a las moléculas simples e indivisibles que componen los cuerpos, es probable que las ignoremos; pero sí, por el contrario, unimos al nombre de elementos o principios de los cuerpos la idea del último término al que se llega por vía analítica, entonces todas las sustancias que hasta ahora no hemos podido descomponer por cualquier medio serán para nosotros otros tantos elementos; con esto no queremos asegurar que los cuerpos que consideramos como simples no se hallen compuestos por dos o mayor número de principios, sino que como nunca se ha logrado separarlos o, mejor dicho, faltándonos los medios para hacerlo, debemos considerarlos cuerpos simples y no compuestos hasta que la experiencia y la observación no demuestren lo contrario.