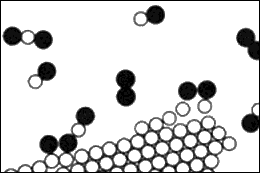
1.8 Carbono quemándose en oxígeno.
En todos los procesos que se han descrito hasta ahora, los átomos y los iones no han cambiado de compañeros, pero por supuesto hay circunstancias en las que los átomos cambian sus combinaciones para formar nuevas moléculas. Esto se ilustra en la figura 1.8. Un proceso en el que tiene lugar una recombinación de los compañeros atómicos es lo que denominamos una reacción química.

1.8 Carbono quemándose en oxígeno.
Los otros procesos descritos hasta ahora se denominan procesos físicos, pero no hay una distinción tajante entre ambos tipos de procesos. (La naturaleza no se preocupa de cómo lo llamemos, simplemente sigue trabajando). Se supone que esta figura representa carbono quemándose en oxígeno. En el caso del oxígeno, dos átomos de oxígeno están adheridos muy fuertemente. (¿Por qué no se adhieren tres o incluso cuatro átomos? Esta es una de las características muy peculiares de tales procesos atómicos. Los átomos son muy especiales: les gustan ciertos compañeros concretos, ciertas direcciones concretas, y así sucesivamente. La tarea de la física consiste en analizar por qué cada uno de ellos quiere lo que quiere. En cualquier caso, dos átomos de oxígeno forman, saturados y felices, una molécula).
Se supone que los átomos de carbono están en un cristal sólido (que podría ser grafito o diamante). Ahora, por ejemplo, una de las moléculas de oxígeno puede llegar al carbono, y cada uno de sus átomos puede recoger un átomo de carbono y salir en una nueva combinación —«carbono-oxígeno»—, que es una molécula de un gas denominado monóxido de carbono. Se le da el nombre químico CO. Es muy simple: las letras «CO» son prácticamente una imagen de dicha molécula. Pero el carbono atrae al oxígeno con mucha más fuerza que el oxígeno atrae al oxígeno o que el carbono atrae al carbono. Por lo tanto, en este proceso el oxígeno puede llegar con sólo una pequeña energía, pero el oxígeno y el carbono saldrán juntos con una enorme violencia y conmoción, y cualquier cosa que haya cerca de ellos recogerá la energía. Entonces se genera una gran cantidad de energía de movimiento, energía cinética. Esto, por supuesto, es la combustión; estamos obteniendo calor a partir de la combinación de oxígeno y carbono. El calor está ordinariamente en forma de movimiento molecular del gas caliente, pero en ciertas circunstancias puede ser tan enorme que genere luz. Así es cómo se obtienen las llamas.
Además, el monóxido de carbono no está totalmente satisfecho. Es posible que se una a otro oxígeno, de modo que podríamos tener una reacción mucho más complicada en la que el oxígeno se está combinando con el carbono y al mismo tiempo tiene lugar una colisión con una molécula de monóxido de carbono. Un átomo de oxígeno podría unirse al CO y formar finalmente una molécula, compuesta de un carbono y dos oxígenos, que se designa CO2 y se denomina dióxido de carbono. Si quemamos el carbono con muy poco oxígeno en una reacción muy rápida (por ejemplo, en un motor de automóvil, donde la explosión es tan rápida que no hay tiempo para hacer dióxido de carbono), se forma una gran cantidad de monóxido de carbono. En muchas de tales recombinaciones se libera una cantidad muy grande de energía, que produce explosiones, llamas, etc., dependiendo de las reacciones. Los químicos han estudiado estas ordenaciones de los átomos y han encontrado que toda sustancia es algún tipo de disposición de átomos.
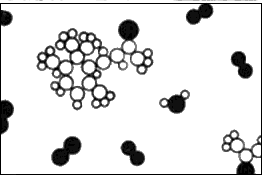
1.9 Aroma de violetas.
Para ilustrar esta idea, consideremos otro ejemplo. Si entramos en un campo de pequeñas violetas, enseguida sabemos qué es «ese olor». Es algún tipo de molécula, o disposición de átomos, que se ha abierto camino hasta el interior de nuestras fosas nasales. Antes de nada, ¿cómo se abrió camino? Eso es bastante fácil. Si el olor es algún tipo de molécula en el aire, agitándose y siendo golpeada desde todas direcciones, podría haber llegado accidentalmente al interior de la nariz. Ciertamente no tiene ningún deseo particular de entrar en nuestra nariz. Es simplemente una indefensa parte de una multitud zigzagueante de moléculas, y en su errar sin rumbo esta porción concreta de materia acaba encontrándose en nuestra nariz.
Ahora los químicos pueden tomar moléculas especiales como las del aroma de las violetas y analizarlas y decirnos la disposición exacta de los átomos en el espacio. Sabemos que la molécula de dióxido de carbono es recta y simétrica: O–C–O. (Esto también puede determinarse fácilmente con métodos físicos). Sin embargo, incluso para las enormemente más complicadas disposiciones de átomos que hay en la química es posible, mediante un largo y notable proceso de trabajo detectivesco, encontrar las disposiciones de los átomos. La figura 1.9 es una imagen del aire cerca de una violeta; de nuevo encontramos nitrógeno y oxígeno en el aire, y vapor de agua. (¿Por qué hay vapor de agua? Porque la violeta está húmeda. Todas las plantas transpiran). Sin embargo, vemos también en la figura 1.10 un «monstruo» compuesto de átomos de carbono, átomos de hidrógeno y átomos de oxígeno, que han elegido una cierta estructura concreta en la que disponerse. Es una disposición mucho más complicada que la del dióxido de carbono; de hecho, es una disposición enormemente complicada. Por desgracia, no podemos representar todo lo que de verdad se conoce sobre ella químicamente, porque la disposición precisa de todos los átomos se conoce realmente en tres dimensiones, mientras que nuestra imagen es sólo bidimensional. Los seis carbonos que forman un anillo no forman un anillo plano, sino un tipo de anillo «arrugado». Se conocen todos los ángulos y las distancias. Así pues, una fórmula química es simplemente una imagen de semejante molécula. Cuando el químico escribe una cosa semejante en la pizarra está tratando de «dibujar», hablando grosso modo, en dos dimensiones. Por ejemplo, vemos un «anillo» de seis carbonos, y una «cadena» de carbonos que cuelga en un extremo, con un oxígeno en el segundo lugar a partir del extremo, tres hidrógenos unidos al carbono, dos carbonos y tres hidrógenos adheridos aquí, etc.
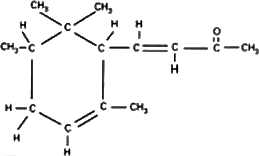
1.10 La sustancia representada es a-irona.
¿Cómo descubre el químico cuál es la disposición? Él mezcla botellas llenas de algún material, y si éste se vuelve rojo, significa que consiste en un hidrógeno y dos carbonos unidos aquí; si se vuelve azul, por el contrario, no es esa la forma ni mucho menos. Esta es una de las más fantásticas piezas de trabajo detectivesco que se han hecho nunca: la química orgánica. Para descubrir la disposición de los átomos en estas formaciones enormemente complicadas, el químico observa qué sucede cuando mezcla dos sustancias diferentes. El físico nunca se acababa de creer que el químico supiera de lo que estaba hablando cuando describía la disposición de los átomos. Desde hace aproximadamente veinte años ha sido posible, en algunos casos, examinar moléculas semejantes (no tan complicadas como estas, pero sí algunas que contienen partes de ella) por un método físico, y ha sido posible localizar cada átomo, no observando colores, sino midiendo dónde están. Y ¡como por arte de magia!, los químicos tienen casi siempre razón.
Resulta, de hecho, que en las violetas hay tres moléculas ligeramente distintas, que difieren sólo en la disposición de los átomos de hidrógeno.
Un problema de la química consiste en dar nombre a una sustancia, de tal modo que sepamos qué es. ¡Encontrar un nombre para esta forma! El nombre no sólo debe decir la forma, sino que también debe decir que aquí hay un átomo de oxígeno, ahí hay un hidrógeno: exactamente qué es y dónde está cada átomo. Es fácil comprender entonces que los nombres químicos deban ser complejos para poder ser completos. Vean ustedes que el nombre de esta cosa en la forma más completa que les revele su estructura es 4-(2,2,3,6 tetrametil-5-ciclohexanil)-3-buten-2-uno, y eso les dice que esta es la disposición. Podemos darnos cuenta de las dificultades que tienen los químicos, y darnos cuenta también de la razón de nombres tan largos. ¡No es que ellos quieran ser oscuros, sino que se enfrentan a un problema extremadamente difícil al tratar de describir las moléculas con palabras!
¿Cómo sabemos que existen los átomos? Por uno de los trucos antes mencionados: hacemos la hipótesis de que existen átomos, y los resultados se siguen uno tras otro de la forma que predecimos, como debería ser si las cosas están hechas de átomos. Existe también una evidencia algo más directa, un buen ejemplo de la cual es el siguiente: los átomos son tan pequeños que ustedes no pueden verlos con un microscopio óptico; de hecho, ni siquiera con un microscopio electrónico. (Con un microscopio óptico ustedes sólo pueden ver cosas que son mucho más grandes). Ahora bien, si los átomos están siempre en movimiento, digamos en agua, y ponemos una bola grande de algo en el agua, una bola mucho más grande que los átomos, la bola se agitará de un lado a otro, de forma muy parecida a un juego en donde un balón muy grande es empujado en todas direcciones por muchas personas. Las personas están empujando en diferentes direcciones, y el balón se mueve en el campo de una forma irregular. De la misma forma, la «gran bola» se moverá debido a las desigualdades de las colisiones en un lado y en otro, y de un instante al siguiente. Así, si miramos partículas muy pequeñas (coloides) en el agua a través de un microscopio excelente, vemos una agitación perpetua de las partículas que es el resultado del bombardeo de los átomos. Esto se denomina movimiento browniano.
Tenemos evidencia adicional de los átomos en la estructura de los cristales. En muchos casos las estructuras deducidas por análisis de rayos X coinciden en sus «formas» espaciales con las formas que realmente muestran los cristales tal como se dan en la naturaleza. Los ángulos entre las diversas «caras» de un cristal coinciden, dentro de un margen de segundos de arco, con los ángulos deducidos de la hipótesis de que un cristal está hecho de muchas «capas» de átomos.
Todo está hecho de átomos. Esta es la hipótesis clave. La hipótesis más importante de toda la biología, por ejemplo, es que todo lo que hacen los animales lo hacen los átomos. En otras palabras, no hay nada que hagan los seres vivos que no pueda ser comprendido desde el punto de vista de que están hechos de átomos que actúan de acuerdo con las leyes de la física. Esto no era conocido desde el principio: se necesitó alguna experimentación y teorización para sugerir esta hipótesis, pero ahora se acepta, y es la teoría más útil para producir nuevas ideas en el campo de la biología.
Si un pedazo de acero o de sal, que consiste en átomos colocados uno detrás de otro, puede tener propiedades tan interesantes; si el agua —que no es otra cosa que estos pequeños borrones, un kilómetro tras otro de la misma cosa sobre la tierra— puede formar olas y espuma y hacer ruidos estruendosos y figuras extrañas cuando corre sobre el cemento; si todo esto, toda la vida de una corriente de agua, no es otra cosa que un montón de átomos, ¿cuánto más es posible? Si en lugar de disponer los átomos siguiendo una pauta definida, repetida una y otra vez, aquí y allí, o incluso formando pequeños fragmentos de complejidad como los que dan lugar al olor de las violetas, construimos una disposición que es siempre diferente de un lugar a otro, con diferentes tipos de átomos dispuestos de muchas formas, con cambios continuos y sin repetirse, ¿cuánto más maravilloso podrá ser el comportamiento de este objeto? ¿Es posible que este «objeto» que se pasea de un lado a otro delante de ustedes, hablándoles a ustedes, sea un gran montón de estos átomos en una disposición muy compleja, tal que su enorme complejidad sorprenda a la imaginación con lo que puede hacer? Cuando decimos que somos un montón de átomos no queremos decir que somos meramente un montón de átomos, porque un montón de átomos que no se repiten de un lugar a otro muy bien podría tener las posibilidades que ustedes ven ante sí en el espejo.